Kategorie: Polecane artykuły » Początkujący elektrycy
Liczba wyświetleń: 36288
Komentarze do artykułu: 1
Źródła prądu chemicznego: główne cechy
 Od ponad dwóch stuleci ludzkość wykorzystuje energię reakcji chemicznych między różnymi substancjami do wytwarzania prądu stałego.
Od ponad dwóch stuleci ludzkość wykorzystuje energię reakcji chemicznych między różnymi substancjami do wytwarzania prądu stałego.
Zasada działania
Reakcji redoks zachodzącej między substancjami o właściwościach utleniacza i reduktora towarzyszy uwalnianie elektronów, których ruch tworzy prąd elektryczny. Jednak w celu wykorzystania tej energii konieczne jest stworzenie warunków dla przejścia elektronów przez obwód zewnętrzny, w przeciwnym razie jest uwalniany do środowiska zewnętrznego przez zwykłe zmieszanie utleniacza i reduktora z ciepłem.
Dlatego wszystkie źródła prądu chemicznego mają dwie elektrody:
-
anoda, na której zachodzi utlenianie;
-
katoda, przeprowadzająca przywracanie substancji.
Elektrody na odległość umieszcza się w naczyniu z elektrolitem - substancją, która przewodzi prąd elektryczny w wyniku procesów dysocjacji ośrodka na jony.
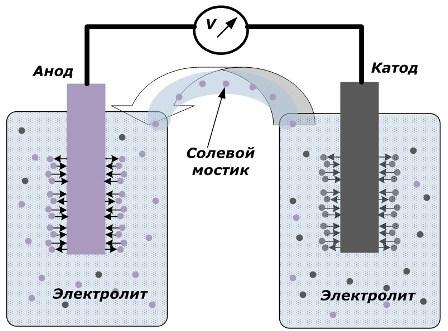
Zasada przekształcania energii chemicznej w energię elektryczną
Rysunek pokazuje, że elektrody są umieszczone w oddzielnych naczyniach połączonych mostkiem solnym, przez który powstaje ruch jonów wzdłuż obwodu wewnętrznego. Gdy obwody zewnętrzne i wewnętrzne są otwarte, na elektrodach zachodzą dwa procesy: przejście jonów z metalu elektrody do elektrolitu i przejście jonów z elektrolitu do sieci krystalicznej elektrod.
Prędkości przepływu tych procesów są takie same, a potencjały napięciowe przeciwnych znaków gromadzą się na każdej elektrodzie. Jeśli zostaną połączone mostem solnym i przyłożone zostanie obciążenie, nastąpi obwód elektryczny. Prąd wewnętrzny jest generowany przez ruch jonów między elektrodami przez elektrolit i mostek solny. Ruch elektronów wzdłuż obwodu zewnętrznego w kierunku od anody do katody.
Niemal wszystkim reakcjom redoks towarzyszy wytwarzanie energii elektrycznej. Ale jego wartość zależy od wielu czynników, w tym od objętości i mas używanych chemikaliów, materiałów użytych do produkcji elektrod, takich jak elektrolit, stężenie jonów, konstrukcja.
Najczęściej stosowane w nowoczesnych źródłach prądu chemicznego to:
-
dla materiału anody (czynnika redukującego) - cynku (Zn), ołowiu (Pb), kadmu (Cd) i niektórych innych metali;
-
dla materiału katodowego (utleniacza) - tlenek ołowiu PbO2, tlenek manganu MnO2, wodorotlenek niklu NiOOH i inne;
-
elektrolity na bazie roztworów kwasów, zasad lub soli.
Metody klasyfikacji
Jedną część chemicznych źródeł energii można ponownie wykorzystać, a drugą nie. Zasada ta stanowi podstawę ich klasyfikacji.
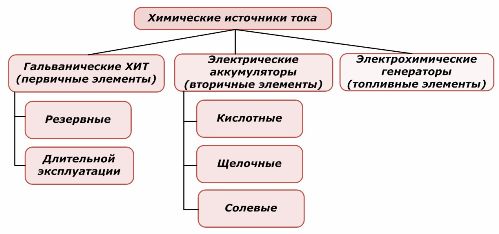
Klasyfikacja pierwiastków chemicznych
Siła elektromotoryczna ogniwa galwaniczne, w zależności od projektu, osiąga 1,2 ÷ 1,5 wolta. Aby uzyskać duże wartości, łączy się je w baterie, łącząc szeregowo. Gdy akumulatory są połączone równolegle, prąd i moc wzrosną.
Ogólnie przyjmuje się, że pierwotne źródła prądu chemicznego nie obsługują ładowania, chociaż dokładniej to stanowisko można sformułować inaczej: jego wdrożenie nie jest ekonomicznie wykonalne.
Nadmiarowe pierwotne źródła prądu chemicznego są przechowywane w stanie, w którym elektrolit jest izolowany od elektrod. Eliminuje to występowanie reakcji redoks i zapewnia gotowość do uruchomienia. Nie są ponownie wykorzystywane. Okres trwałości chemicznych źródeł zasilania rezerwowego jest ograniczony do 10–15 lat.
Akumulatory są z powodzeniem ładowane przez zastosowanie zewnętrznej energii elektrycznej. Ze względu na tę funkcję nazywane są wtórnymi źródłami prądu. Są w stanie wytrzymać setki i tysiące cykli rozładowania.EMF akumulatora może mieścić się w zakresie 1,0 ÷ 1,5 wolta. Są one również łączone w baterie.
Generatory elektrochemiczne działają na zasadzie ogniw galwanicznych, ale w celu przeprowadzenia reakcji elektrochemicznej substancje pochodzą z zewnątrz, a wszystkie uwolnione produkty są usuwane z elektrolitu. Pozwala to zorganizować ciągły proces.
Kluczowe cechy wydajności chemicznych źródeł zasilania
1. Napięcie na otwartych zaciskach
W zależności od projektu pojedyncze źródło może stworzyć tylko pewną różnicę potencjałów. Do użytku w urządzeniach elektrycznych są one połączone w baterie.
2. Określona pojemność
Przez pewien czas (w godzinach) jedno źródło prądu chemicznego może generować ograniczoną ilość prądu (w amperach), które przypisuje się do jednostki masy lub objętości.
3. Gęstość mocy
Charakteryzuje zdolność jednostki masy lub objętości źródła prądu chemicznego do generowania mocy wytwarzanej przez iloczyn napięcia według siły prądu.
4. Czas trwania operacji
Ten parametr jest również nazywany datą ważności.
5. Wartość prądów samorozładowujących
Te boczne procesy reakcji elektrochemicznych prowadzą do zużycia masy czynnej pierwiastków, powodują korozję i zmniejszają pojemność właściwą.
6. Cena produktu
Zależy od projektu, użytych materiałów i wielu innych czynników.
Najlepszymi źródłami prądu chemicznego są te o wysokich wartościach pierwszych czterech parametrów, a samorozładowanie i koszt są niskie.
Zasady ładowania baterii
Wśród wtórnych źródeł prądu chemicznego zyskują dużą popularność. modele litowo-jonowe, które stały się szeroko stosowane do zasilania urządzeń elektronicznych. Wykorzystują LiMO2 (M Co, Ni, Mn) jako materiał elektrody dodatniej, a grafit jako elektrodę ujemną.
Po naładowaniu jony litu z przyłożonej energii zewnętrznej są uwalniane z metalu katody, przechodzą przez elektrolit i wnikają w przestrzeń między warstwami grafitu, gromadząc się tam.
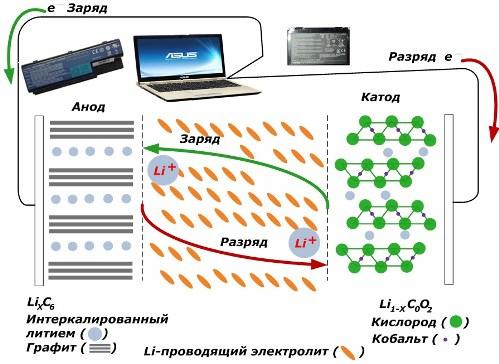
Kiedy energia ładowarka jest nieobecny, a ładunek jest podłączony do elektrod, a następnie jony litu w elektrolicie poruszają się w przeciwnym kierunku.
Jeśli ładowanie i rozładowywanie nie zostanie przeprowadzone, energia w akumulatorze nie zostanie zużyta, ale zmagazynowana. Ale jego ilość jest ograniczona właściwościami użytych materiałów. Na przykład w akumulatorach litowo-jonowych właściwa pojemność elektryczna wynosi 130 ÷ 150 mAh / g. Jest to ograniczone właściwościami materiału anody. W przypadku grafitu pojemność jest około dwa razy wyższa.
Naukowcy szukają obecnie sposobów na zwiększenie pojemności baterii, badają możliwość zastosowania reakcji chemicznej między litem a tlenem w powietrzu. Aby to zrobić, opracowuje się konstrukcje z powietrzną, niepodatną na zużycie katodą, stosowaną w oddzielnych bateriach. Ta metoda może zwiększyć gęstość energii do 10 razy.
Działanie chemicznych źródeł prądu wymaga wiedzy podstawy elektrotechniki, elektrochemia, materiałoznawstwo i fizyka ciała stałego.
Zobacz także na bgv.electricianexp.com
:
